Química Geral e Ciência dos Materiais
Introdução à Química Geral
A química e a ciência dos materiais consistem no estudo da estrutura da matéria e suas transformações. Todos os materiais que nos rodeiam são formados por elementos químicos ligados de diferentes formas, tais como o solo, os alimentos, o corpo humano e o silício (utilizado na fabricação dos equipamentos tecnologia), entre outros. Nesse sentido, a química e a ciência dos materiais constituem a base dos conhecimentos voltados para os cursos de Engenharia e ciências exatas correlatas, relacionando-se com os demais conteúdos abordados nessa área de formação. Nesta unidade, serão apresentados os conteúdos iniciais de Química Geral, mostrando a importância do desenvolvimento e seleção de materiais, a estrutura atômica e a distribuição eletrônica, a tabela e as propriedades periódicas, além das ligações químicas iônica, covalente e metálica.
A química é uma ciência que visa entender melhor alguns acontecimentos que ocorrem no nosso cotidiano, cujo estudo está associado à estrutura, composição e transformação da matéria. Trata-se de uma ciência central, comum às diversas áreas de formação, e está relacionada aos diversos bens de consumo utilizados por nossa sociedade, tais como produção de medicamentos, produtos de limpeza doméstica, materiais para automóveis, alimentos, cosméticos, combustíveis, plásticos e vidro, dentre outros, e graças às suas contribuições têm sido possíveis os avanços da tecnologia e da sociedade nas mais diversas áreas do conhecimento.
Durante muito tempo, a indústria química exerceu um papel significativo com relação à poluição do planeta, ocasionando, muitas vezes, danos irreversíveis, a exemplo da extração de minérios, descarte de materiais tóxicos, contaminação de efluentes, dentre outros. Dessa forma, um dos papéis importantes da química consiste em buscar soluções para o paradigma entre a necessidade de consumo dos recursos naturais e a sua preservação. Entre os desafios a serem vencidos, podemos citar alguns exemplos, como:
A química também está diretamente relacionada às propriedades dos materiais utilizados para diferentes aplicações. O sucesso do produto final depende fortemente do material utilizado. A escolha do material deve levar em conta suas propriedades, estrutura interna, composição, comportamento frente a ataques químicos, térmicos ou esforços mecânicos, além do custo de fabricação. Nesse sentido, algumas propriedades do material podem ser predominantes na hora de fazer a escolha para determinada aplicação ou produto específico.
A escolha de um bom material vai determinar a confiabilidade, durabilidade e viabilidade econômica de um projeto. Portanto, é de extrema importância saber quais são os materiais mais adequados para um projeto específico, balanceando eficiência, qualidade e custo.
A seleção de materiais deve seguir uma série de critérios. Com relação a esses critérios, são feitas algumas afirmações. Assinale a alternativa que corresponde a um princípio correto relativo à seleção de materiais.
A ideia de átomo foi proposta pelo filósofo Leucipo (478 a.C.) e aperfeiçoada e propagada pelo seu discípulo Demócrito. Eles descreveram os átomos como pequenas partículas que constituíam a matéria. Tais partículas representavam a menor porção possível da matéria e, portanto, eram indivisíveis. Somente após milhares de anos, essa ideia foi substituída por modelos baseados em estudos experimentais.
Esse modelo, desenvolvido por John Dalton, em 1808, baseou-se em reações químicas e pesagens minuciosas, chegando à conclusão de que os átomos realmente existiam e que possuíam algumas características, entre elas:
Dalton determinou que os átomos são maciços, esféricos e indivisíveis, semelhantes a uma bola de bilhar (Figura 1.1).
Esse modelo foi desenvolvido por Joseph John Thomson, em 1897. Thomson verificou que o átomo não é indivisível, mas possui partículas carregadas negativamente. Essas partículas de carga negativa são os elétrons. Sugeriu que o átomo poderia ser uma esfera maciça carregada positivamente na qual alguns elétrons estariam uniformemente distribuídos. Como um todo, o átomo seria eletricamente neutro, tendo o mesmo número de cargas positivas (na massa do átomo) e cargas negativas (elétrons mergulhados) (Figura 1.2).
Esse modelo foi desenvolvido por Ernest Rutherford, em 1911, cujo experimento consistiu em bombardear uma fina lâmina de ouro (0,00001 cm) com pequenas partículas portadoras de carga elétrica positiva, chamadas de partículas alfa, emitidas por certos materiais radioativos, como o polônio.
A partir desse experimento, Rutherford observou que:
A Figura 1.3 mostra, esquematicamente, o experimento realizado.
A partir dos experimentos de Rutherford, verificou-se que o átomo é formado por um núcleo denso, que contém prótons e nêutrons, rodeado pelos elétrons distribuídos por todo o volume restante do átomo (eletrosfera). De maneira esquemática, as regiões do átomo estão divididas conforme mostra a Figura 1.4.
Rutherford constatou que o átomo é constituído por três partículas subatômicas, sendo elas: o próton, o nêutron e o elétron. Dentre as partículas subatômicas, os prótons e nêutrons possuem massa significativa, e o elétron possui massa desprezível. Com relação às cargas, o próton possui carga positiva, o elétron possui carga negativa e o nêutron não possui carga. A Tabela 1.1 apresenta as características dessas partículas.
O modelo atômico de Rutherford ficou conhecido como “modelo planetário”, uma vez que nele, o átomo se assemelha ao Sistema Solar com os elétrons girando ao redor do núcleo (Figura 1.5), assim como os planetas giram ao redor do Sol.
A partir do modelo atômico de Rutherford, foi possível estabelecer algumas características para os átomos dos diferentes elementos, sendo elas o número atômico e número de massa.
1. Número atômico (Z):
O número atômico indica a quantidade de prótons existentes no núcleo de um átomo. É representado pela letra “Z”.
Como os átomos são neutros, temos que: Nº de prótons = Nº de elétrons.
2. Número de massa (A):
O número de massa (A) é a soma do número de prótons (p) e o número de nêutrons (n), logo: A = p + n.
A representação de um elemento químico, quanto ao seu número atômico e número de massa, é feita da seguinte maneira:
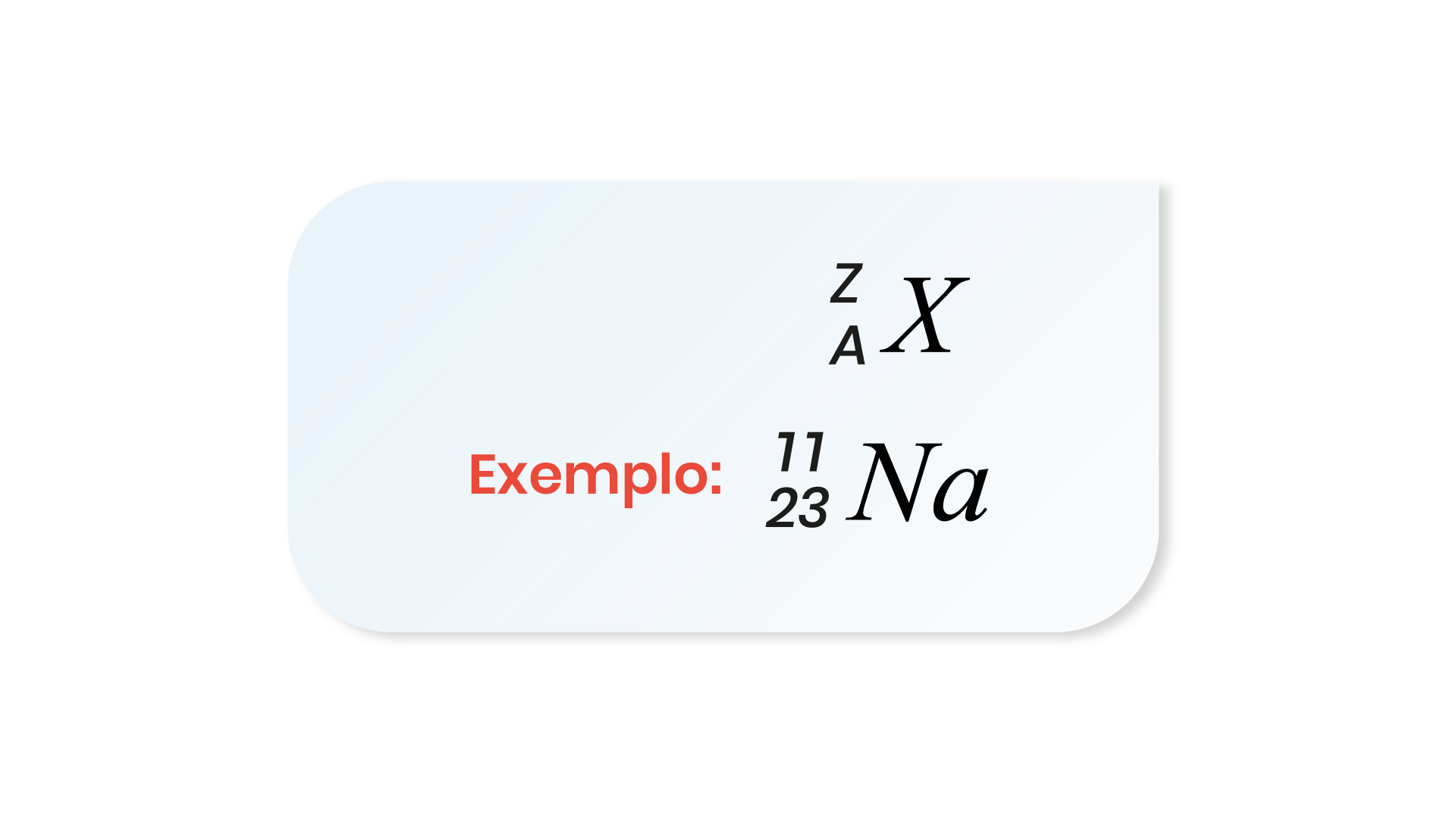
Onde “X” é um elemento genérico com número de massa “A” e número atômico “Z”.
O modelo atômico de Rutherford foi aperfeiçoado por Böhr. Baseado na teoria quântica proposta por Planck, Bohr elaborou os seguintes postulados:
I) Os elétrons que giram ao redor do núcleo não giram ao acaso, mas descrevem órbitas determinadas sem emitirem nem absorverem energia.
II) Ao receber energia, o elétron pode saltar para outra órbita, mais energética. Quando o átomo retorna à sua órbita original, ele libera a energia que foi absorvida, em forma de luz ou calor.
Essas órbitas foram denominadas níveis de energia ou camadas eletrônicas e apresentam valores de energia específicos para cada átomo. Sete níveis de energia foram definidos pelas letras K, L, M, N, O, P e Q e sua energia aumenta à medida que os níveis se afastam do núcleo. A Figura 1.6 mostra a distribuição das camadas eletrônicas ao redor do núcleo. Para a camada mais externa, dá-se o nome de camada de valência.
Cada camada energética comporta um número máximo de elétrons. Os elétrons sempre vão ocupar os níveis energéticos mais baixos, para então ocupar níveis de maior energia. A Tabela 1.2 mostra o número máximo de elétrons por níveis de energia.
Ao pesquisar o átomo, Sommerfeld concluiu que os elétrons de um mesmo nível ocupam órbitas de trajetórias diferentes (circulares e elípticas). Essas trajetórias foram denominadas subníveis. Os subníveis podem ser de quatro tipos: s , p , d , f, estando em ordem crescente de energia (s < p < d < f). Elétrons situados no mesmo subnível contêm a mesma quantidade de energia e se distribuem pela eletrosfera, ocupando o subnível de menor energia. O número máximo de elétrons por subnível está mostrado na Tabela 1.3.
Para tornar mais fácil a distribuição dos elétrons nos níveis e subníveis de energia dos átomos, o cientista Linus Pauling (1901-1994) criou uma representação gráfica com o objetivo de facilitar a distribuição eletrônica por ordem crescente de energia, que ficou conhecida como diagrama de Pauling (Figura 1.7). O uso desse diagrama consiste em distribuir os elétrons seguindo a ordem mostrada pelas setas nas diagonais, começando pelo topo até atingir o número de elétrons correspondente a um determinado átomo.
Exemplos: \(_{11}\)Na: 1s\(^{2}\) 2s\(^{2}\) 2p\(^{6}\) 3s\(^{1}\)
\(_{30}\)Zn: 1s\(^{2}\) 2s\(^{2}\) 2p\(^{6}\) 3s\(^{2}\) 3p\(^{6}\) 3d\(^{10}\) 4s\(^{2}\)
Schrödinger apresentou um modelo atômico no qual os elétrons eram considerados como partículas-onda. Esse modelo era baseado na teoria da mecânica ondulatória, que determinou o conceito de “orbital”, a região do espaço ao redor do núcleo onde existe a máxima probabilidade de se encontrar o elétron. O modelo de Schrödinger, válido até hoje, procura determinar os valores permitidos de energia para os elétrons de um átomo e mostra que é impossível conhecermos a trajetória de um elétron.
Um determinado átomo, em seu estado fundamental, apresenta número atômico igual a 13 e o número de massa igual a 27. Sobre ele, é correto afirmar que:
A tabela periódica é um instrumento de consulta que relaciona as estruturas dos elementos químicos conhecidos com o modelo atômico de subníveis e explica algumas de suas propriedades periódicas. Em 1869, Dmitri Mendeleev elaborou uma forma de organizar os elementos químicos de acordo com suas propriedades, deixando espaços em branco, de forma que pudessem ser preenchidos por novos elementos que viessem a ser descobertos. Mendeleev organizou os elementos de acordo com a ordem crescente de suas massas atômicas e notou que, nessa sequência, apareciam a intervalos regulares elementos com propriedades semelhantes, daí a denominação de propriedades periódicas.
Em 1913, Moseley, ao trabalhar com uma técnica envolvendo raios X, descobriu uma característica numérica dos átomos de cada elemento, conhecida como “número atômico”, que, posteriormente, foi associado ao número de prótons. Dessa forma, verificou-se que, ao organizar os elementos em função da ordem crescente de seus respectivos números atômicos, corrigiam-se algumas inconsistências da tabela elaborada por Mendeleev. E, assim, a tabela periódica foi reformulada e, atualmente, os elementos químicos estão dispostos em ordem crescente de número atômico. A Figura 1.8 mostra a organização dos elementos químicos na tabela periódica.
Na tabela periódica, as colunas, ou linhas verticais, são chamadas de grupos ou famílias, sendo numeradas de 1 a 18. Os elementos localizados na mesma família possuem, em geral, o mesmo número de elétrons na camada de valência. Já as linhas horizontais são chamadas de períodos, variando de 1 a 7. Os elementos localizados em um mesmo período possuem o mesmo número de camadas eletrônicas.
A simbologia utilizada para cada elemento na tabela periódica está mostrada na Figura 1.9, sendo composta de:
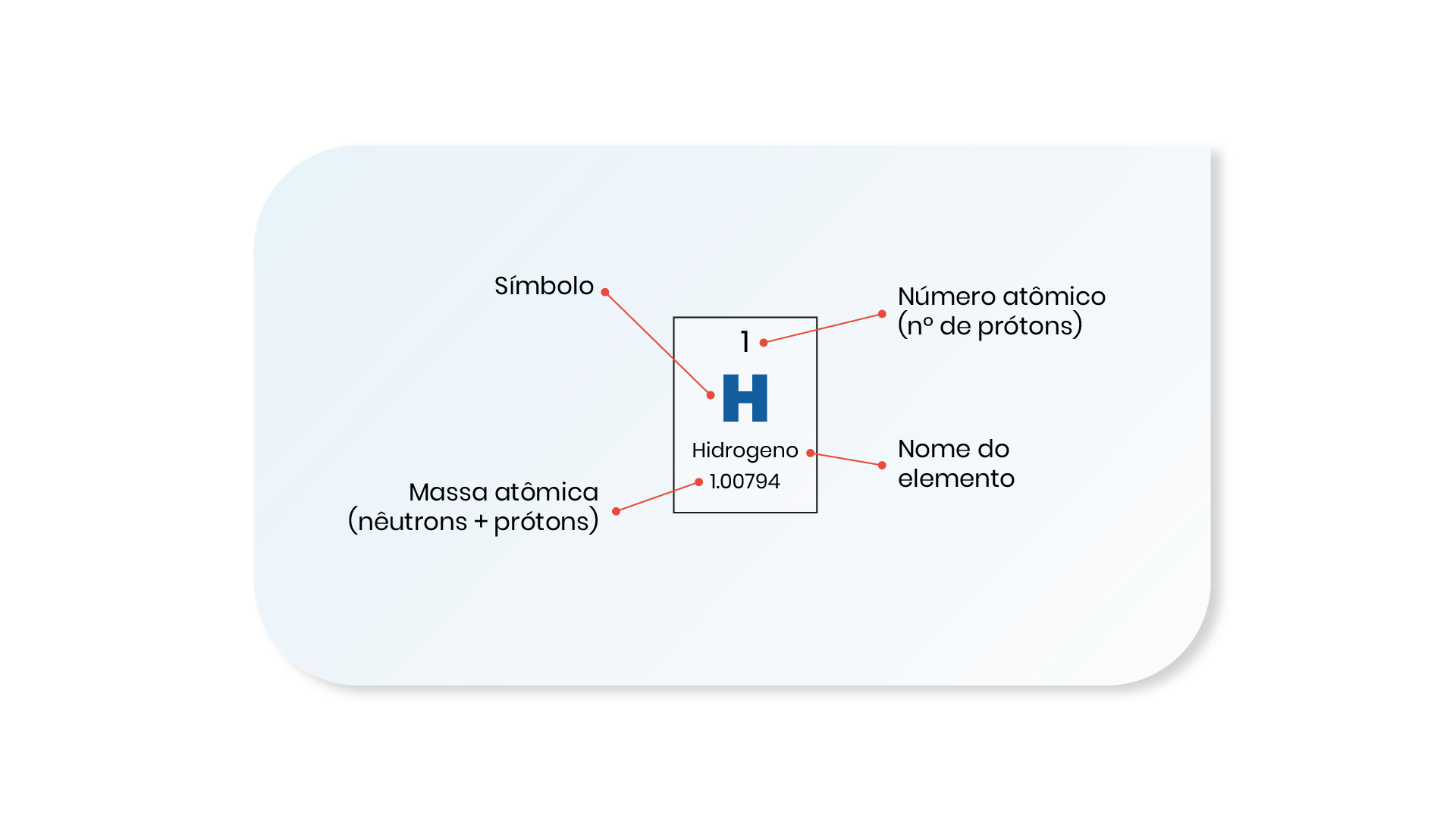
Os elementos presentes na tabela periódica podem ser classificados sob diferentes formas. As Figuras 1.10 e 1.11 apresentam duas formas diferentes de classificação.
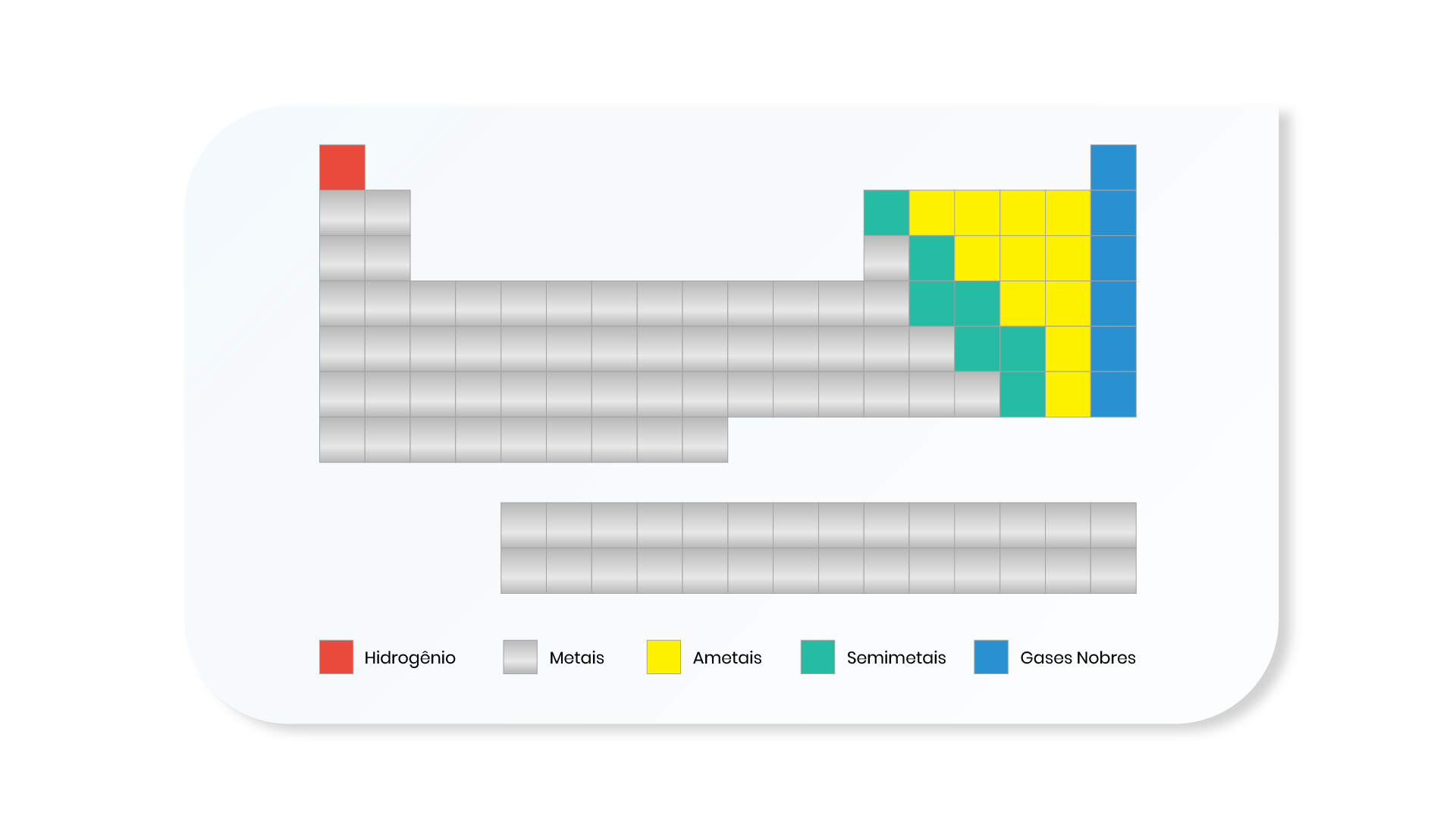
Conheça as principais características das diferentes classificações dos elementos químicos:
Fonte: Adaptado de Bettelheim et al . (2012).
As propriedades periódicas são aquelas que, à medida que o número atômico aumenta, assumem valores crescentes ou decrescentes em cada período. Algumas das propriedades periódicas são:
aumenta com o aumento do número de camadas eletrônicas para os átomos dos elementos de uma mesma família e, diminui com o aumento do número atômico ( prótons), para os átomos dos elementos localizados em um mesmo período (quanto maior o número de prótons maior será a atração sobre os elétrons e menor será o tamanho do átomo).
é a energia necessária para remover um ou mais elétrons de um átomo isolado, neutro e no estado gasoso. Quanto maior o raio atômico, menor será a atração exercida pelo núcleo sobre o elétron e menor será a energia necessária para remover o elétron.
É a energia envolvida quando um átomo “captura” um elétron. Quanto menor o raio atômico, maior a eletroafinidade.
Dados os elementos químicos:
G: 1s\(^{2}\)
J: 1s\(^{2}\) 2s\(^{1}\)
L: 1s\(^{2}\) 2s\(^{2}\)
M: 1s\(^{2}\) 2s\(^{2}\) 2p\(^{6}\) 3s\(^{2}\)
Assinale a alternativa cujos elementos químicos apresentam propriedades químicas semelhantes aos apresentados:
Os átomos ligam-se, isto é, eles tendem a perder, ganhar ou compartilhar elétrons, procurando adquirir configuração eletrônica do gás nobre mais próximo e, com isso, alcançar sua estabilidade. Isso ocorre em decorrência de os gases nobres possuírem sua camada de valência completa, com oito elétrons. O átomo pode adquirir uma configuração de gás nobre doando, recebendo ou compartilhando elétrons da camada de valência.
Os átomos que possuem 1, 2 ou 3 elétrons na camada de valência tendem a ceder seus elétrons. Os átomos que possuem 5, 6 ou 7 elétrons na camada de valência tendem a atrair elétrons. Os átomos que possuem 4 elétrons na camada de valência compartilham seus elétrons, dependendo do elemento químico em questão.
Ao doar ou receber elétrons, formam-se os íons. As espécies que doam elétrons se transformam em cátions, e as espécies que recebem elétrons se transformam em ânions. Os cátions são representados por X\(^{+n}\), onde n é o número de elétrons doados, e os ânions são representados por XX\(^{-n}\), onde n é o número de elétrons recebidos.
Existem três tipos de ligações químicas intramoleculares (ligações entre átomos):
Numa ligação química, só são transferidos ou compartilhados os elétrons de valência, ou seja, os elétrons da camada mais externa do átomo. Para representar esses elétrons, utilizamos a representação de Lewis. A Figura 1.12 mostra exemplos da representação de Lewis.

Ocorrem entre átomos de metais e ametais:
Essa ligação acontece por atração eletrostática de íons com cargas opostas, formando os compostos iônicos.
A fórmula dos compostos iônicos é escrita seguindo as regras apresentadas:
Exemplo de representação da fórmula do composto iônico (Figura 1.13):
Na ligação covalente, o par de elétrons passa a pertencer simultaneamente aos dois átomos, ocorrendo um compartilhamento de elétrons. Ocorre entre átomos que têm tendência para receber elétrons, ou seja, entre ametais, ametal + Hidrogênio e Hidrogênio + Hidrogênio. Os átomos compartilham elétrons, formando pares eletrônicos. Como consequência desse compartilhamento, formam-se as moléculas A Figura 1.14 mostra dois exemplos de ligação covalente, utilizando a representação de Lewis.
É uma ligação que envolve um “amontoado” organizado de íons metálicos positivos mergulhados em um “mar de elétrons” livres, chamado “modelo do mar de elétrons”. Esse tipo de ligação apresenta uma grande movimentação eletrônica, o que acaba influenciando nas principais características dos metais: boa condutividade térmica e elétrica, além de alta maleabilidade e ductibilidade.
Pode ser formada uma grande quantidade de ligas combinando os metais entre si ou com outros elementos da tabela periódica.
Saiba mais sobre as ligações químicas, fazendo a leitura do artigo a seguir, que apresenta detalhes interessantes sobre as ligações químicas:
As ligações químicas ocorrem entre os átomos para formar moléculas. Esse fenômeno ocorre com a intenção de tornar os elementos envolvidos mais estáveis. O tipo de ligação química depende dos elementos que estão se ligando. Dessa forma, as ligações químicas existentes entre os átomos dos compostos HI, NH\(_{3}\) e NaCl são, respectivamente:

Peter William Atkins e Loreta Jones.
Editora: Bookman Companhia Editor
ISBN: 8540700387
Comentário: o livro mostra, de forma bastante completa, o conteúdo abordado nesta unidade, com diversas aplicações e exemplos práticos de uso dos conhecimentos de Química Geral.

Ano: 2012
Comentário: o vídeo aborda, com uma linguagem simples e direta, os conceitos de ligações químicas iônica, covalente e metálica.
Para saber mais sobre o filme, acesse o link:
Nesta unidade, aprendemos os princípios gerais da Química, iniciando com alguns exemplos de aplicação da química na atuação do profissional, e sua relação com a seleção de materiais. Vimos a evolução da teoria atômica, abordando as principais características do átomo, como o número atômico, o número de massa e a distribuição de elétrons nos níveis e subníveis energéticos, utilizando o diagrama de Linus Pauling. Vimos, também, que os elementos são organizados em ordem crescente de número atômico na tabela periódica. Essa organização permite que algumas propriedades apareçam de forma periódica na tabela, entre elas o raio atômico, a energia de ionização e a eletroafinidade. Por fim, aprendemos que as ligações químicas que ocorrem entre os átomos podem ser: iônicas, covalentes e metálicas.
BETTELHEIM, F.; BROWN, W. H.; CAMPBELL, M. K.; FARREL, S. O. Introdução à química geral . São Paulo: Cengage Learning, 2012.
BROWN, T. E. Química : a ciência central. 13. ed. São Paulo: Pearson Prentice Hall, 2017.
MODELO_budin_de_pasas_thumb_2_.jpg. DCC: Ciência de la Computación Universidad de Chile . [2019]. Disponível em: https://wiki.dcc.uchile.cl/alice/lib/exe/detail.php?id=p4_2014_39_g3&media=modelo_budin_de_pasas_thumb_2_.jpg . Acesso em: 7 dez. 2019.
SECRETARIA DA EDUCAÇÃO. Experimento de Rutherford . [2019]. Disponível em: http://www.quimica.seed.pr.gov.br/modules/galeria/detalhe.php?foto=1356&evento= . Acesso em: 7 dez. 2019.